- Le istruzioni per l’uso costituiscono un elemento regolatorio critico del dispositivo medico: incidono direttamente sulla sicurezza, sull’uso previsto e sulla responsabilità del fabbricante nei confronti delle autorità competenti.
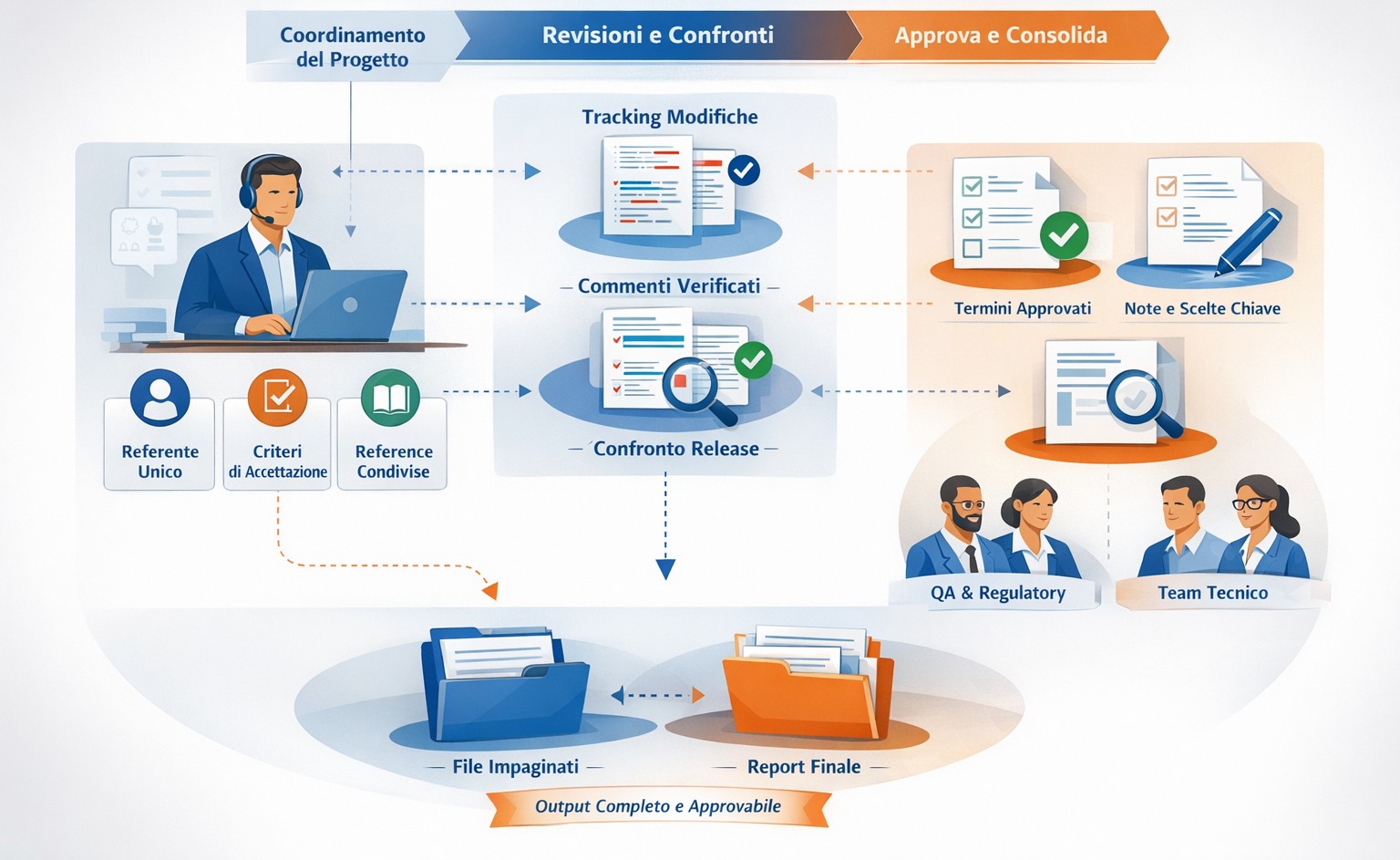
- La loro gestione linguistica richiede un presidio strutturato: governo dei requisiti normativi, coerenza terminologica tra le lingue, tracciabilità delle scelte e continuità documentale lungo l’intero ciclo di vita del dispositivo.

Quando e perché la traduzione delle istruzioni è un intervento governato
La traduzione delle istruzioni per l’uso dei dispositivi medici è funzionale alla corretta applicazione dell’uso previsto, alla comprensione delle avvertenze e al rispetto delle condizioni di sicurezza definite dal fabbricante. È un’attività regolata, strettamente connessa alla documentazione tecnica e parte integrante del sistema di conformità del dispositivo.
Un intervento professionale diventa necessario in presenza di più mercati e lingue, di requisiti MDR o IVDR, o di aggiornamenti post-market che impattano sulle istruzioni per l’uso. In questi scenari, la traduzione deve essere governata come processo: controllo terminologico, coerenza tra versioni, tracciabilità delle modifiche e allineamento continuo con i contenuti approvati, a tutela del fabbricante e degli utilizzatori finali.
Punti sensibili nella traduzione delle istruzioni per dispositivi medici
La traduzione delle istruzioni per l’uso non è un’attività accessoria. È un presidio documentale che incide sulla conformità regolatoria del dispositivo, sulla sicurezza dell’utilizzatore e sulla responsabilità giuridica del fabbricante. Errori linguistici, ambiguità terminologiche o disallineamenti tra versioni possono generare non conformità regolatorie, rilievi ispettivi, azioni correttive e, nei casi più critici, richiami di prodotto.
- Allineamento obbligatorio tra istruzioni per l’uso, uso previsto e documentazione tecnica approvata
- Impatto diretto delle scelte linguistiche sulla sicurezza e sulla corretta applicazione del dispositivo
- Gestione della conformità MDR e IVDR in presenza di più lingue e mercati
- Rischio di interpretazioni divergenti tra versioni linguistiche
- Aggiornamenti post-market e gestione controllata delle modifiche alle istruzioni e all’etichettatura
- Responsabilità del fabbricante in caso di non conformità legate alla documentazione linguistica
Governance linguistica e conformità regolatoria delle istruzioni d’uso
Identifichiamo il contesto regolatorio del tuo progetto
Progetti linguistici in ambito medicale
Contenuti medicali complessi, gestiti in ambienti regolati con metodo e controllo. Dalla documentazione per imaging diagnostico e dispositivi elettromedicali certificati ai contenuti clinici e vaccinali, ogni progetto è seguito con attenzione terminologica, coerenza tra versioni e conformità linguistica e normativa.






